臨床實(shí)踐中,類風(fēng)濕性關(guān)節(jié)炎(RA)的精確診斷治療仍是一個(gè)艱巨挑戰(zhàn)。探索化療放療等現(xiàn)代治療方法的新應(yīng)用有望改善RA的治療效果。
2024年2月28日,山西醫(yī)科大學(xué)張瑞平、Zheng Ziliang、Dai Rong共同通訊在Advanced Science在線發(fā)表題為“A Novel Activatable Nanoradiosensitizer for Second Near-Infrared Fluorescence Imaging-Guided Safe-Dose Synergetic Chemo-Radiotherapy of Rheumatoid Arthritis”的研究論文,該研究將臨床批準(zhǔn)的藥物順鉑(DDP)和吲哚菁綠(ICG)封裝在明膠殼內(nèi),開發(fā)了一種新型可激活納米放射增敏劑-40(IRnR-40),實(shí)現(xiàn)了第二近紅外光(NIR-IIFL)成像引導(dǎo)的安全劑量協(xié)同化療。
IRnR-40響應(yīng)RA微環(huán)境中高濃度的基質(zhì)金屬蛋白酶-9(MMP-9),快速釋放功能分子DDP和ICG。釋放的ICG具有雙重作用,在幫助精確描繪目標(biāo)關(guān)節(jié)體積、引導(dǎo)放射治療的同時(shí),也能量化DDP的釋放,實(shí)時(shí)監(jiān)測治療效果。釋放的DDP通過活性氧(ROS)介導(dǎo)的線粒體凋亡實(shí)現(xiàn)對RA的高效協(xié)同化療和放射增敏。綜上所述,該研究制備了可活化納米放射增敏劑IRnR-40,首次嘗試對RA進(jìn)行高效NIR-IIFL成像引導(dǎo)的安全劑量放化療,為難治性疾病的精確治療診斷提供了新參考。

類風(fēng)濕性關(guān)節(jié)炎(RA)被稱為“不死癌癥”,是一種與持續(xù)性滑膜炎相關(guān)的自身免疫性炎癥性疾病。類風(fēng)濕性關(guān)節(jié)炎滑膜成纖維細(xì)胞(RASF)的異常增殖是滑膜炎的關(guān)鍵病理特征之一,分泌大量促炎因子和基質(zhì)金屬蛋白酶(MMP)。明膠酶MMP-9是最重要的MMP之一,在類風(fēng)濕性關(guān)節(jié)炎炎癥、關(guān)節(jié)破壞和骨侵蝕中起關(guān)鍵作用。MMP-9在RA滑膜組織和滑液中異常高表達(dá),與RA的疾病進(jìn)展和嚴(yán)重程度呈正相關(guān)。RA的主要治療方法包括使用非甾體抗炎藥(NSAID)等化學(xué)藥物、改善病情的抗類風(fēng)濕性關(guān)節(jié)炎藥物(DMARD)和糖皮質(zhì)激素(GC),以緩解癥狀并控制關(guān)節(jié)炎的進(jìn)展。然而,由于非特異性靶向和生物利用度差,這些藥物大多會(huì)導(dǎo)致各種不良反應(yīng),特別是對于晚期RA來說治療效果較差。因此,迫切需要開發(fā)一種新的治療診斷策略,旨在誘導(dǎo)增殖性滑膜成纖維細(xì)胞損傷以治療RA。放射治療(RT)一直是惡性腫瘤治療的基礎(chǔ),同樣用于良性病理疾病。放射滑膜切除術(shù)是治療多種急性和慢性炎癥關(guān)節(jié)疾病的成熟療法,通過關(guān)節(jié)內(nèi)注射發(fā)射β射線的放射性核素以產(chǎn)生過多的活性氧(ROS),破壞增殖性滑膜。不幸的是,復(fù)雜的技術(shù)和先進(jìn)的操作設(shè)備限制了其在臨床應(yīng)用中的普及。值得注意的是,低劑量X射線放療(LD-RT)已用于臨床治療自身免疫性疾病。研究表明,LD-RT具有優(yōu)異的抗炎和免疫調(diào)節(jié)特性,可減輕RA疼痛并減少骨破壞。然而,傳統(tǒng)LD-RT的療效有限,因其放射抗性、對正常組織不可避免的損傷以及輻射誘發(fā)腫瘤潛在副作用,臨床效果欠佳。因此,實(shí)現(xiàn)增生滑膜的精準(zhǔn)可視化并制備高效的放射增敏劑是開發(fā)新型滑膜切除術(shù)以提高RA放療效果的關(guān)鍵因素。
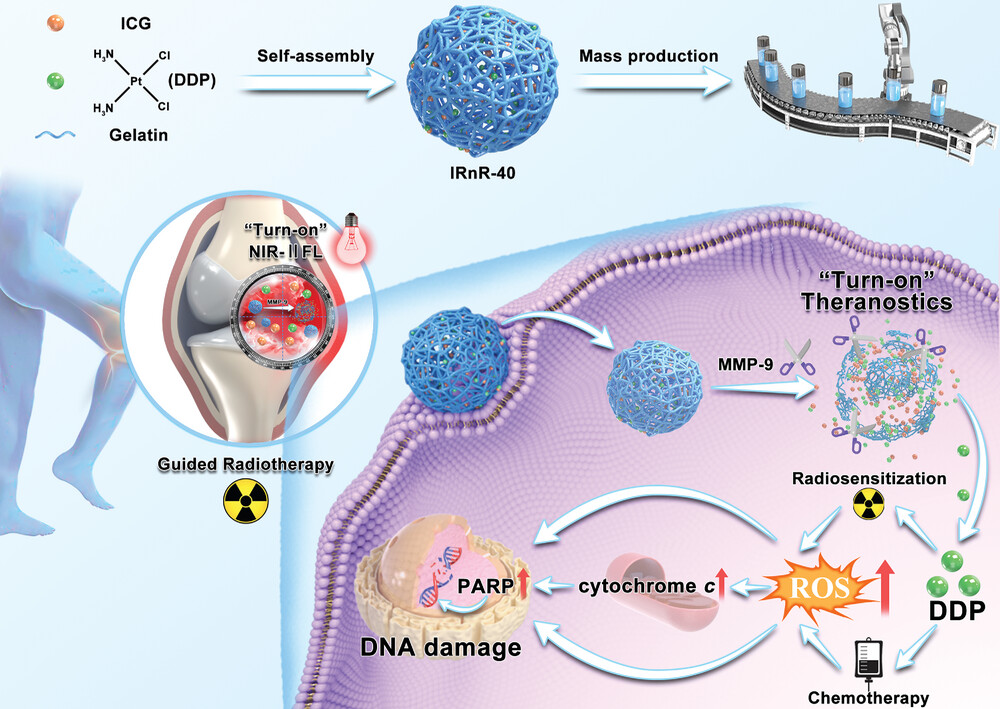
圖1 IRnR-40制劑、可激活藥物釋放和NIR-II FL成像引導(dǎo)的安全劑量放化療示意圖(摘自Advanced Science)
傳統(tǒng)的圖像引導(dǎo)放射治療(IGRT)和錐形束計(jì)算機(jī)斷層掃描(CBCT)存在固有局限性,圖像分辨率不足且難以實(shí)時(shí)動(dòng)態(tài)監(jiān)測疾病。新興的第二近紅外光(NIR-IIFL,1000-1700nm)體內(nèi)成像的特點(diǎn)是實(shí)時(shí)監(jiān)測、空間分辨率高且能夠動(dòng)態(tài)追蹤目標(biāo)區(qū)域變化,具備精確描繪目標(biāo)體積以指導(dǎo)放療的潛力。目前,生物相容性吲哚菁綠(ICG)因其在NIR-II窗口的拖尾發(fā)射,在臨床實(shí)踐中得到廣泛應(yīng)用。有趣的是,納米大小的ICG可以在NIR-IIFL中實(shí)現(xiàn)被動(dòng)的實(shí)時(shí)動(dòng)態(tài)監(jiān)測。盡管如此,在NIR-IIFL成像中,利用ICG區(qū)分病變部位和周圍正常組織仍具有挑戰(zhàn)性,需要提高其特異性和敏感性。“可激活”策略能夠在病變部位的獨(dú)特微環(huán)境中響應(yīng)性激活NIR-IIFL,有助于成像納米探針的開發(fā)。因此,賦予ICG響應(yīng)性激活特性可以提高定位靶向RA異常增生滑膜組織的特異性和敏感性,成為放療中精確靶點(diǎn)可視化的首選。近年來,多功能納米探針在治療診斷學(xué)的臨床應(yīng)用中優(yōu)勢明顯。納米技術(shù)的發(fā)展為探索安全有效的放射增敏納米材料提供了新方向,多種具有高效遞送性能的金屬基(高原子序數(shù)(Z)元素,包括Pt、Hf和Au)納米放射增敏劑已進(jìn)入臨床試驗(yàn),甚至第2-3期階段,表明納米放射增敏劑在臨床上應(yīng)用潛力巨大。含有高Z元素Pt的順鉑(DDP)可顯著加劇ROS誘導(dǎo)的DNA損傷,并已廣泛用于腫瘤放射增敏治療。此外,DDP是最常用的化療藥物之一,可與DNA產(chǎn)生鏈間和鏈內(nèi)交聯(lián)并干擾DNA修復(fù),誘導(dǎo)DNA損傷和癌細(xì)胞凋亡。與放射療法結(jié)合使用時(shí),DDP可增強(qiáng)靶體積中ROS擴(kuò)增誘導(dǎo)的細(xì)胞死亡。



