X射線誘導(dǎo)余輝和放射動力治療解決了光學成像和光療的組織穿透問題。然而,用于該治療的無機納米熒光粉的放射余輝動態(tài)功能一直處于開啟狀態(tài),限制了其檢測特異性和治療效果。
2023年9月4日,南洋理工大學浦侃裔,福州大學宋繼彬及山西省人民醫(yī)院張瑞平共同通訊在Nature Materials在線發(fā)表題為”Molecular radio afterglow probes for cancer radiodynamic theranostics“的研究論文,該研究報道了X射線照射后具有近紅外余輝和1O2產(chǎn)生的有機發(fā)光團(IDPAs)用于癌癥治療。IDPA的體內(nèi)放射余輝亮度是無機納米磷光體的25.0倍以上,而放射性動力學產(chǎn)生的1O2比市售的放射性增敏劑高5.7倍以上。
IDPA的模塊化結(jié)構(gòu)允許開發(fā)一種智能分子探針,僅在癌癥生物標志物存在時觸發(fā)其放射余輝動態(tài)功能。因此,該探針能夠以極好的對比度(腫瘤與背景比為234)對小腫瘤(0.64 mm)進行超靈敏檢測,并在低劑量下以分子精度對腦腫瘤進行腫瘤特異性放療。總之,該研究工作揭示了有機放射余輝劑的分子開發(fā)指南,并強調(diào)了癌癥放射治療的新機遇。

光學顯像劑在生物學和醫(yī)學中有著廣泛的應(yīng)用,為診斷和光治療提供了分子特異性。然而,光與組織的相互作用限制了光劑在表面或內(nèi)窺鏡下可及的組織中的成像和治療能力。因此,能夠儲存光能并在光照射停止后釋放光子的余輝劑已經(jīng)出現(xiàn),以緩解這一問題。由于消除了組織自身熒光,這種光余輝劑可以以高靈敏度檢測深層組織中的生物標志物。然而,光前照射的前提條件,由于光的穿透深度有限,使得光余輝劑在深層組織中難以重復(fù)誘導(dǎo)信號和光療作用,限制了其轉(zhuǎn)化潛力。與光相比,X射線具有穿透深層組織的能力,可以將高能光子送入人體,用于診斷成像和癌癥放療。受射電發(fā)光機制的啟發(fā),X射線最近被用來代替光來誘導(dǎo)余輝成像。然而,這種射電余輝成像(RAI)劑很少被報道,并且僅限于少數(shù)稀土摻雜的無機納米熒光粉。同樣,X射線可以作為能量源,啟動光劑的光動力過程,以實現(xiàn)放射動力治療(RDT)。由于光劑局部產(chǎn)生細胞毒性活性氧(ROS), RDT可以最大限度地減少對正常組織的輻射損傷,并在深部組織中發(fā)揮腫瘤消融作用。由于大多數(shù)光敏劑不直接響應(yīng)X射線,無機納米熒光粉通常用作換能器,將X射線光子下轉(zhuǎn)換為光,用于光敏劑的原位激發(fā)。
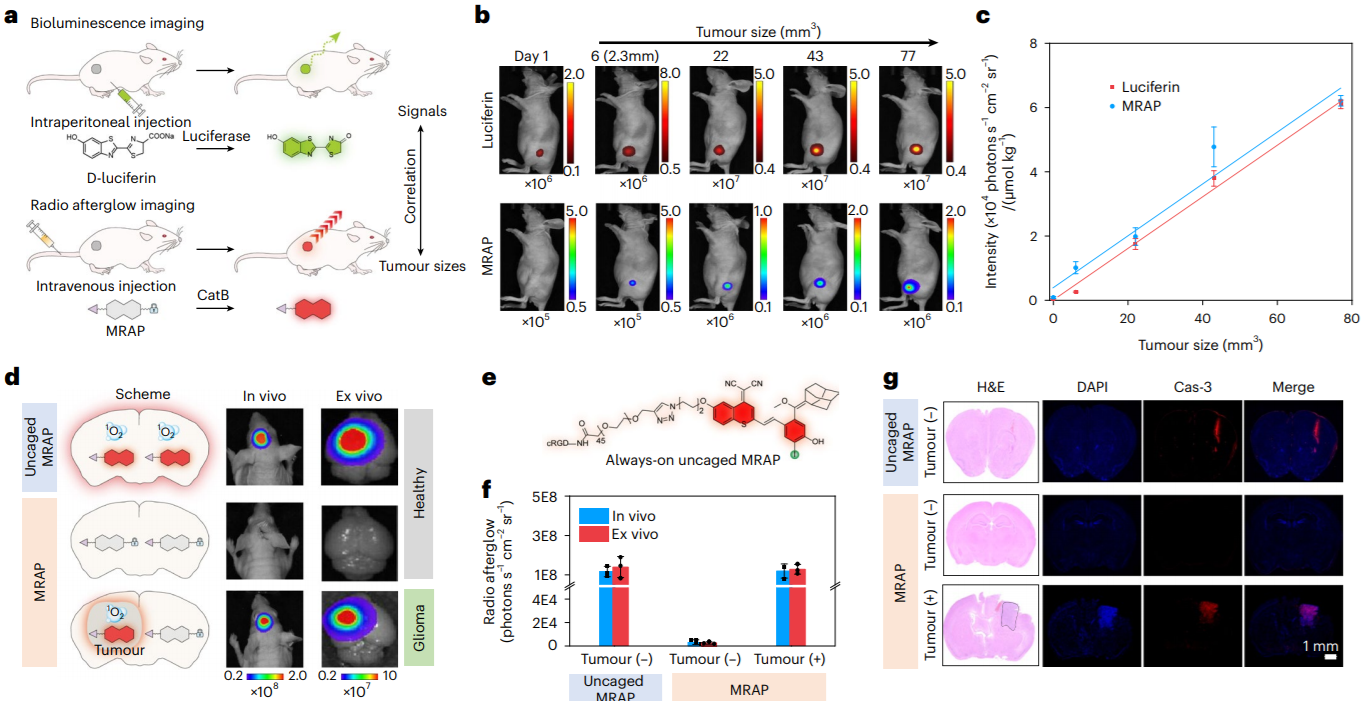
MRAP介導(dǎo)的超小腫瘤檢測及精準腫瘤消融盡管RAI和RDT在腫瘤學中具有轉(zhuǎn)化潛力,但目前只有無機納米顆粒可用;此外,由于它們的放射功能與生物標志物無關(guān),并且總是處于開啟狀態(tài),因此癌癥的檢測和治療效果嚴重依賴于腫瘤和正常組織之間的濃度差異,導(dǎo)致特異性較差。與無機納米顆粒相比,有機分子具有明確的結(jié)構(gòu),有助于精確控制生理特性。然而,有機分子通常含有輕原子(如氫、碳和氧)和弱自旋軌道耦合;因此,它們在X射線照射下具有較弱的X射線吸收,較短的放射發(fā)光壽命和較差的單線態(tài)氧生成。因此,沒有有機分子在X射線照射后發(fā)出余輝的報道。該研究報道了有機發(fā)光團的發(fā)展,它可以有效地經(jīng)歷放射動力學過程,產(chǎn)生單線態(tài)氧(1O2)并發(fā)射無線電余輝,用于精確的癌癥治療。除了可調(diào)諧的近紅外發(fā)射,長半衰期和高效的1O2生成外,這些無線電發(fā)光團的結(jié)構(gòu)多功能性使其能夠構(gòu)建智能可激活探針,僅在靶向癌癥生物標志物存在時才開啟其無線電余輝動態(tài)過程。該研究描述了這些放射性發(fā)光團的合成和性質(zhì),研究了潛在的機制和光誘導(dǎo)過程的潛在優(yōu)勢,并評估了它們在臨床前診斷和治療深部腦腫瘤方面的潛力。



